Información para l@s alumn@s y familias:
Criterios de evaluación y contenidos de 2º ESO Física y Química
Indicadores observables y evaluables
Rúbrica de valoración del cuaderno de clase
Informe prácticas de laboratorio
Compromiso del alumno en el laboratorio
Reflexiona sobre lo aprendido con los estándares evaluables de aprendizaje
Comentarios y evaluación docente
Apuntes 2º ESO en pdf:
- El método científico
- La unidad y la medida
- Ciencia y tecnología en nuestra cotidiana
- Laboratorio
- La materia
- Sistemas materiales
- Disoluciones
- Modelos atómicos
- La tabla periódica
- Enlace químico
- Introducción a la formulación inorgánica
- Reacciones química
- El movimiento
- Las fuerzas
- La energía
- Cuadernillo refuerzo
- Materiales adaptados
- Adaptación curricular 2º ESO
- Metodología científica
- Metodología científica II
- La materia
- La materia II
- Estados de agregación
- Estados de agregación II
- Cambios químicos
- Cambios químicos II
- Fuerzas y movimiento
- Fuerzas y movimiento II
- Energía mecánica
- Energía mecánica II
- Energía térmica
- Energía térmica II
- Fuentes de energía
- Fuentes de energía II
Una medida experimental se expresa mediante un intervalo determinado por el valor numérico obtenido, con todas sus cifras significativas, y el error absoluto correspondiente, que supondremos igual a la resolución del instrumento de medida.
ACTIVIDAD II: ACTIVIDAD DE NORMAS DE LABORATORIO Y PICTOGRAMAS
La materia tiene como propiedades generales la masa y el volumen, todos los cuerpos independientemente del estado de agregación tienen una masa y ocupan un volumen.
ACTIVIDAD I: Relación entre la masa y el volumen
Los principales estados de agregación de la materia son tres; sólido líquido y gaseoso.
Los sólidos tienen forma y volumen constantes, los líquidos se caracterizan por tener volumen constante y forma variable y los gases tienen forma y volumen variable.
El modelo cinético-molecular de la materia se basa en que la materia es discontinua, sus partículas están en movimiento debido a dos clases de fuerzas: de cohesión y de repulsión.
Cambios que ABSORBEN energía (PROGRESIVOS):
Fusión: Paso de sólido a líquido (ej.: el hielo se derrite).
Vaporización: Paso de líquido a gas. Tiene dos variantes:
Ebullición: Ocurre en toda la masa del líquido y a una temperatura fija para cada presión.
Evaporación: Ocurre solo en la superficie del líquido y a cualquier temperatura.
Sublimación: Paso directo de sólido a gas, sin pasar por el estado líquido (ej.: el hielo seco -CO₂ sólido- o las pastillas de naftalina).
Cambios que LIBERAN energía (REGRESIVOS):
Solidificación: Paso de líquido a sólido (ej.: el agua se convierte en hielo).
Condensación: Paso de gas a líquido (ej.: el vapor de agua forma gotitas en un vaso frío).
Sublimación Inversa: Paso directo de gas a sólido, sin pasar por el estado líquido (ej.: la formación de escarcha en una noche fría).
ACTIVIDAD: Los cambios de estado
Para experimentar con los cambios de estados puedes ver el siguiente video:
- Se representan los cambios de estado progresivos: fusión (sólido a líquido) y vaporización (líquido a gas).
- Tramos inclinados: La temperatura aumenta a medida que se agrega calor y la sustancia permanece en un solo estado (sólido, líquido o gaseoso).
- Tramos rectos: La temperatura permanece constante durante los cambios de estado. La energía se usa para romper los enlaces en lugar de aumentar la temperatura. El primer tramo recto representa la fusión (sólido a líquido). El segundo tramo recto representa la vaporización (líquido a gas)
- Se representan los cambios de estado regresivos: condensación (gas a líquido) y solidificación (líquido a sólido).
- Tramos inclinados: La temperatura disminuye a medida que se pierde calor y la sustancia se mantiene en un solo estado.
- Tramos rectos: La temperatura es constante durante los cambios de estado. La energía se libera para formar los enlaces. El primer tramo recto representa la condensación (gas a líquido). El segundo tramo recto representa la solidificación (líquido a sólido).
- La temperatura de condensación (gas a líquido) es la misma que la temperatura de ebullición (líquido a gas).
- La temperatura de solidificación (líquido a sólido) es la misma que la temperatura de fusión (sólido a líquido).
ACTIVIDAD I: Concepto de Temperatura
ACTIVIDAD II: Escalas de Temperatura
El volumen es el espacio que ocupa un cuerpo. La unidad de volumen en el Sistema Internacional es una magnitud derivada que se denomina metro cúbico (m3)
ACTIVIDAD III: Concepto de Volumen
ACTIVIDAD IV: Concepto de Presión
SUSTANCIAS PURAS,MEZCLAS Y DISOLUCIONES
- Sustancia pura es aquella materia homogénea que tiene una composición química definida en toda su extensión y se puede identificar por una serie de propiedades características. Las sustancias puras se clasifican, a su vez, en elementos y compuestos:
- Un elemento químico es una sustancia pura que no puede descomponerse en otras más simples.
- Un compuesto químico es una sustancia pura que, mediante procesos químicos, puede descomponerse en otras más simples.
- Una mezcla es un sustancia material de composición variable, formado por dos o más sustancias puras que pueden separarse utilizando procedimientos físicos. Las mezclas se clasifican en mezclas heterogéneas y mezclas homogéneas o disoluciones:
- Una mezcla heterogénea es aquella en la que pueden distinguirse sus componentes a simple vista o con el microscopio óptico. Distinguimos las dispersiones coloidales y las suspensiones.
- Una mezcla homogénea o disolución es aquella en la que no es posible distinguir sus componentes a simple vista o con el microscopio óptico.ACTIVIDAD I: Sustancias Puras, Mezclas y DisolucionesACTIVIDAD II: Clasificación de la materiaACTIVIDAD III: Repasa las mezclas
ACTIVIDAD IV:
- Soluto. Es la sustancia que se disuelve y es el componente que se encuentra en menor proporción.
- Disolvente. Es la sustancia que disuelve al soluto y es el componente que se encuentra en mayor proporción.
BEBIDAS AZUCARADAS
Consumir con frecuencia bebidas azucaradas contribuye al exceso de peso, aumentando el riesgo de desarrollar obesidad, diabetes, enfermedades cardiovasculares y algunos tipos de cáncer.
¿Por qué consumir bebidas azucaradas pone en riesgo tu salud?
- Las bebidas azucaradas contienen unicamente azúcares añadidos.
- No generan saciedad
- Contienen calorías vacías y no proporciona otros nutrientes como vitaminas, fibra o proteína.
LECTURA: Bebidas azucaradas
PRÁCTICA: Bebidas azucaradas
Repasa el tema en los siguientes sitios webs: Princast y FyQ en Flash
Este vídeo también te ayudará:
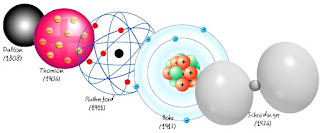
Modelo de Dalton: Propone que los átomos están formados por esferas compactas e indivisibles. Explica adecuadamente los aspectos ponderales de las reacciones químicas, pero es insuficiente para explicar la naturaleza eléctrica de la materia.
- El núcleo está formado por los protones, con carga eléctrica positiva, y los neutrones, eléctricamente neutros.
- El número atómico. Es el número de protones que tiene el núcleo. Se representa con la letra Z y coincide con el número de electrones cuando el átomo es neutro. Todos los átomos de un elemento químico tienen el mismo número atómico.
- El número másico. Es el número total de partículas que hay en el núcleo de un átomo (protones y neutrones). Se representa con la letra A.
- Los isótopos son átomos del mismo elemento que tienen el mismo número atómico, pero distinto número másico.
ACTIVIDAD VI: El átomo y su constitución
ACTIVIDAD VII : Isótopos Isótopos Protones, Neutrones y Electrones
- Grupos: Son las columnas verticales. Los elementos en el mismo grupo comparten la misma configuración electrónica en su capa de valencia y, por lo tanto, tienen propiedades químicas similares. Hay 18 grupos en la tabla periódica.
- Periodos: Son las filas horizontales. Cada periodo representa un nivel de energía principal de los electrones. Hay 7 periodos en total en la tabla periódica.
- El enlace iónico es la unión que resulta de la presencia de fuerzas de atracción electrostática entre iones de distinto signo.
- El enlace covalente es la unión de dos átomos que comparten uno o más pares de electrones.
- El enlace metálico es la unión que existe entre los átomos de los metales, que se encuentran formando una red cristalina.
NÚMERO ATÓMICO Y NUMERO MÁSICO
El número atómico (Z) es el número de protones en el núcleo de un átomo, define al elemento químico y se representa como subíndice (ejemplo: 8O).
El número másico (A) es la suma de protones y neutrones (A = Z + N) y representa la masa principal del átomo, indicando también sus isótopos, se escribe como superíndice (ejemplo: 168O)
El valor de los neutrones se calcula restando Z de A (N = A - Z).
El número atómico y el número másico nos sirve para conocer la estructura del átomo.
ACTIVIDAD : Los átomos se combinan
Existen varios tipos de enlaces químicos como son el iónico, covalente y químico
- El enlace iónico es el resultado de la fuerzas de atracción electrostática entre iones de distinto signo.
- El enlace covalente es la unión de dos o más átomos que comparten uno o más pares de electrones para conseguir la configuración estable de gas noble.
- En el enlace metálico todos los átomos comparten los electrones del nivel más externo, dando lagar a redes cristalinas metálicas
ACTIVIDAD: Enlace químico
ACTIVIDAD: Tipos de enlaces
ACTIVIDAD: Propiedad de los enlaces
ACTIVIDAD: Uniones entre átomos
ACTIVIDAD: Repasa los enlaces
ACTIVIDAD: Póster Digital sobre el Agua
ACTIVIDAD: Constructor de Moléculas
Os dejo estos enlaces para practicar Nomenclatura y Formulación
- Formulación FisQuiWeb
- Formulación AlonsoFormula
- Formulación La Manzana de Newton
- Ejercicios de Formulación
- Test de Formulación
- Ponencia sobre Formulación y Nomenclatura Universidad de Sevilla
- Orientaciones PAU 2012 Madrid
- Apps para móviles
ACTIVIDAD: Concepto de reacción química
ACTIVIDAD: Simulación síntesis del agua
ACTIVIDAD: Simulación de la Precipitación del Diyoduro de plomo
- Energía suficiente para que se rompan los enlaces entre átomos de reactivos. La energía mínima necesaria para que se produzca la reacción se denomina energía de activación.
- Orientación adecuada para que, al romperse los enlaces, los átomos libres se puedan unir de la manera que requiere la formación de productos.
ACTIVIDAD: Ajuste de reacciones
ACTIVIDAD: Ajuste de reacciones II
ACTIVIDAD: Ajuste de reacciones III
ACTIVIDAD: Ajuste de reacciones IV
ACTIVIDAD: Velocidad de reacción y factores de los que depende
- Reacciones endotérmicas tienen lugar con absorción de energía en forma de calor.
- Reacciones exotérmicas transcurren con desprendimiento de energía en forma de calor.
Cuando un objeto se mueve en línea recta decimos que su movimiento es rectilíneo. Si este movimiento es siempre a la misma velocidad, se llama movimiento rectilíneo uniforme (MRU).
EJERCICIOS DE CINEMÁTICA I
EJERCICIOS DE CINEMÁTICA II
LAS FUERZAS
Una fuerza es toda acción capaz de producir alguna deformación en los cuerpos sobre los que actúa o alterar su estado de reposo o de movimiento. La dinámica es la rama de la física que describe la evolución en el tiempo de un sistema físico en relación con los motivos o causas que provocan los cambios de estado físico y/o estado de movimiento. El objetivo de la dinámica es describir los factores capaces de producir alteraciones de un sistema físico, cuantificarlos y plantear ecuaciones de movimiento o ecuaciones de evolución para dicho sistema de operación.
- Primera ley: Todo cuerpo mantiene su estado de movimiento hasta que actúa una fuerza sobre él
- Segunda ley: La aceleración que sufre un cuerpo es proporcional a la fuerza que actúa sobre él.
- Tercera ley: Cuando un cuerpo ejerce una fuerza sobre otro, recibe esa misma fuerza en sentido contrario.
ACTIVIDAD VII: Construye un dinamómetro
ACTIVIDAD VIII: Construye una brújula
ACTIVIDAD IX: La vida de Newton
ACTIVIDAD X: Calcula tu peso en otros planetas
EJERCICIOS DE DINÁMICA
EJERCICIOS DE FUERZAS Y PRESIONES
CONSERVACIÓN DE LA ENERGÍA MECÁNICA
La Energía cinética es la energía asociada a los cuerpos que se encuentran en movimiento, depende de la masa y de la velocidad del cuerpo. La energía cinética, Ec, se mide en julios (J)
El Principio de conservación de la energía indica que la energía no se crea ni se destruye; sólo se transforma de unas formas en otras. En estas transformaciones, la energía total permanece constante; es decir, la energía total es la misma antes y después de cada transformación.
- Cuando la energía cinética aumenta la energía potencial gravitatoria disminuye,
- Cuando la energía potencial gravitatoria aumenta la energía cinética disminuye.
.png)





















No hay comentarios:
Publicar un comentario